Tecnologia Científica
Pesquisadores do MIT criam novo modelo do cérebro humano para viabilizar pesquisas sobre doenças e descoberta de medicamentos
Cultivados a partir de células-tronco pluripotentes induzidas, os 'miBrains' integram todos os principais tipos de células cerebrais e modelam estruturas cerebrais, interações celulares, atividade e características patológicas.
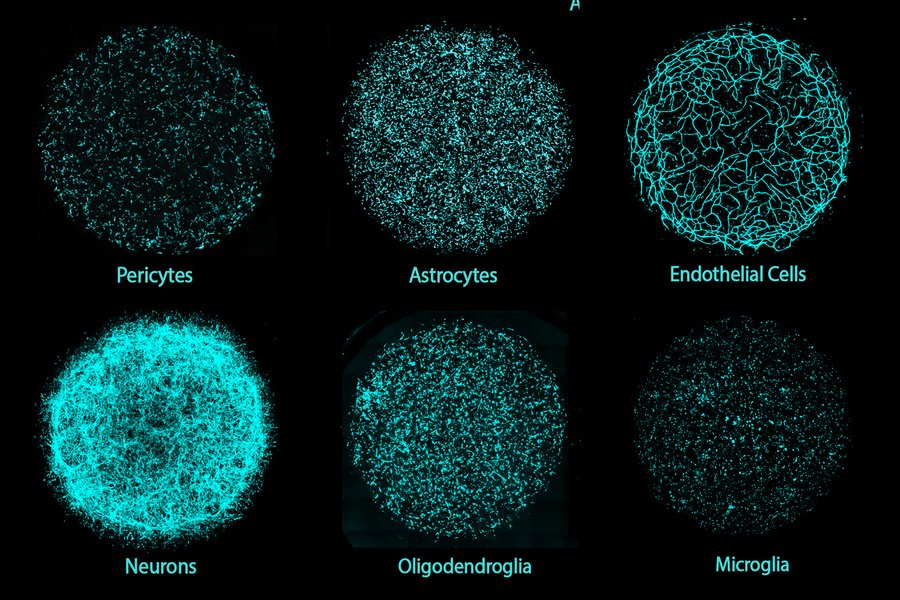
Pesquisadores do MIT inventaram uma cultura de tecido cerebral humano em 3D composta pelos seis principais tipos de células. Cada tipo é cultivado independentemente a partir de células-tronco pluripotentes induzidas de um doador, possibilitando modelos cerebrais personalizados. Combinadas, as células nas culturas miBrain recapitulam características básicas da fisiologia e função cerebral e podem ser geneticamente modificadas para o estudo de doenças como o Alzheimer. Créditos: Imagem cedida pelos laboratórios Langer e Tsai.
Uma nova plataforma de tecido cerebral humano em 3D, desenvolvida por pesquisadores do MIT, é a primeira a integrar todos os principais tipos de células cerebrais, incluindo neurônios, células da glia e vasos sanguíneos, em uma única cultura.
Cultivados a partir de células-tronco pluripotentes induzidas de doadores individuais, esses modelos — denominados Cérebros Integrados Multicelulares (miBrains) — replicam características e funções essenciais do tecido cerebral humano, são facilmente personalizáveis por meio da edição genética e podem ser produzidos em quantidades que viabilizam pesquisas em larga escala.
Embora cada unidade seja menor que uma moeda de dez centavos, o miBrains pode ser muito valioso para pesquisadores e desenvolvedores de medicamentos que precisam de modelos de laboratório vivos mais complexos para entender melhor a biologia do cérebro e tratar doenças.
“O miBrain é o único sistema in vitro que contém todos os seis principais tipos de células presentes no cérebro humano”, afirma Li-Huei Tsai , Professora Picower, diretora do Instituto Picower para Aprendizagem e Memória e autora sênior do estudo de acesso aberto que descreve o miBrain, publicado em 17 de outubro nos Anais da Academia Nacional de Ciências (Proceedings of the National Academy of Sciences ).
“Em sua primeira aplicação, a miBrains nos permitiu descobrir como um dos marcadores genéticos mais comuns da doença de Alzheimer altera as interações celulares para produzir a patologia”, acrescenta ela.
Os coautores seniores de Tsai são Robert Langer , Professor do Instituto David H. Koch (1962), e Joel Blanchard, professor associado da Escola de Medicina Icahn do Monte Sinai, em Nova York, e ex-pós-doutorando do Laboratório Tsai. O estudo é liderado por Alice Stanton, ex-pós-doutoranda dos laboratórios de Langer e Tsai e atualmente professora assistente da Escola de Medicina de Harvard e do Hospital Geral de Massachusetts, e Adele Bubnys, ex-pós-doutoranda do laboratório Tsai e atual cientista sênior da Arbor Biotechnologies.
Benefícios de dois tipos de modelos
Quanto mais um modelo reproduzir a complexidade do cérebro, melhor ele será para extrapolar o funcionamento da biologia humana e como potenciais terapias podem afetar os pacientes. No cérebro, os neurônios interagem entre si e com diversas células auxiliares, todas organizadas em um ambiente tecidual tridimensional que inclui vasos sanguíneos e outros componentes. Todas essas interações são necessárias para a saúde, e qualquer uma delas pode contribuir para o desenvolvimento de doenças.
Culturas simples de apenas um ou alguns tipos de células podem ser criadas em grande quantidade com relativa facilidade e rapidez, mas não permitem aos pesquisadores compreender as inúmeras interações essenciais para o entendimento da saúde ou da doença. Modelos animais incorporam a complexidade do cérebro, mas podem ser difíceis e caros de manter, lentos para produzir resultados e suficientemente diferentes dos humanos para, ocasionalmente, gerar resultados divergentes.
Os miBrains combinam as vantagens de cada tipo de modelo, mantendo grande parte da acessibilidade e rapidez das linhagens celulares cultivadas em laboratório, ao mesmo tempo que permitem aos pesquisadores obter resultados que refletem mais fielmente a complexa biologia do tecido cerebral humano. Além disso, são derivados de pacientes individuais, o que os torna personalizados para o genoma de cada pessoa. No modelo, os seis tipos de células se auto-organizam em unidades funcionais, incluindo vasos sanguíneos, defesas imunológicas e condução de sinais nervosos, entre outras características. Os pesquisadores garantiram que os miBrains também possuam uma barreira hematoencefálica capaz de controlar quais substâncias podem entrar no cérebro, incluindo a maioria dos medicamentos tradicionais.
“O miBrain é uma conquista científica muito empolgante”, diz Langer. “As tendências recentes de minimizar o uso de modelos animais no desenvolvimento de medicamentos podem tornar sistemas como este ferramentas cada vez mais importantes para a descoberta e o desenvolvimento de novos alvos terapêuticos para humanos.”
Duas misturas ideais para modelos cerebrais funcionais.
Desenvolver um modelo que integrasse tantos tipos de células apresentou desafios que exigiram muitos anos para serem superados. Entre os mais cruciais estava a identificação de um substrato capaz de fornecer estrutura física para as células e sustentar sua viabilidade. A equipe de pesquisa inspirou-se no ambiente que envolve as células no tecido natural, a matriz extracelular (MEC). A “neuromatrix” à base de hidrogel do miBrain imita a MEC do cérebro com uma mistura personalizada de polissacarídeos, proteoglicanos e membrana basal que fornece um arcabouço para todos os principais tipos de células cerebrais, ao mesmo tempo que promove o desenvolvimento de neurônios funcionais.
Uma segunda combinação também se mostraria crucial: a proporção de células que resultaria em unidades neurovasculares funcionais. As proporções exatas dos tipos celulares têm sido objeto de debate nas últimas décadas, com até mesmo as metodologias mais avançadas fornecendo apenas orientações gerais, por exemplo, 45-75% para oligodendrócitos em relação ao total de células ou 19-40% para astrócitos.
Os pesquisadores desenvolveram os seis tipos de células a partir de células-tronco pluripotentes induzidas doadas por pacientes, verificando que cada tipo de célula cultivada recriava fielmente as células cerebrais naturais. Em seguida, a equipe realizou iterações experimentais até encontrar um equilíbrio de tipos de células que resultasse em unidades neurovasculares funcionais e estruturadas adequadamente. Esse processo trabalhoso se revelaria uma característica vantajosa do miBrains: como os tipos de células são cultivados separadamente, cada um pode ser geneticamente editado para que o modelo resultante seja adaptado para replicar estados específicos de saúde e doença.
“Seu design altamente modular diferencia o miBrain, oferecendo controle preciso sobre entradas celulares, antecedentes genéticos e sensores — recursos úteis para aplicações como modelagem de doenças e testes de medicamentos”, afirma Stanton.
Descoberta da doença de Alzheimer usando o miBrain
Para testar as capacidades do miBrain, os pesquisadores embarcaram em um estudo da variante genética APOE4, que é o preditor genético mais forte para o desenvolvimento da doença de Alzheimer. Embora um tipo de célula cerebral, os astrócitos, seja conhecido por ser um dos principais produtores da proteína APOE, o papel que os astrócitos portadores da variante APOE4 desempenham na patologia da doença ainda é pouco compreendido.
Os microcélulas MiBrain eram ideais para a tarefa por dois motivos. Primeiro, elas integram astrócitos com outros tipos de células cerebrais, permitindo a reprodução de suas interações naturais com outras células. Segundo, como a plataforma permitiu à equipe integrar os tipos celulares individualmente, os astrócitos APOE4 puderam ser estudados em culturas onde todos os outros tipos celulares carregavam APOE3, uma variante genética que não aumenta o risco de Alzheimer. Isso possibilitou aos pesquisadores isolar a contribuição dos astrócitos APOE4 para a patologia.
Em um experimento, os pesquisadores examinaram astrócitos APOE4 cultivados isoladamente, em comparação com aqueles cultivados em microcérebros APOE4 (miBrains). Eles descobriram que somente nos miBrains os astrócitos expressavam muitas medidas de reatividade imunológica associadas à doença de Alzheimer, sugerindo que o ambiente multicelular contribui para esse estado.
Os pesquisadores também rastrearam as proteínas amiloide e tau fosforilada, associadas à doença de Alzheimer, e descobriram que os miBrains com genótipo APOE4 acumulavam essas proteínas, enquanto os miBrains com genótipo APOE3 não, como esperado. No entanto, em miBrains com genótipo APOE3 e astrócitos com genótipo APOE4, eles observaram que os miBrains com genótipo APOE4 ainda exibiam acúmulo de amiloide e tau.
Em seguida, a equipe aprofundou-se em como as interações dos astrócitos APOE4 com outros tipos celulares poderiam contribuir para a patologia da doença. Estudos anteriores já haviam implicado a comunicação molecular com as células imunes da microglia no cérebro. Notavelmente, quando os pesquisadores cultivaram miBrains APOE4 sem microglia, a produção de tau fosforilada foi significativamente reduzida. Quando os pesquisadores administraram aos miBrains APOE4 meio de cultura de astrócitos e microglia combinados, a tau fosforilada aumentou, enquanto que, quando administraram meio de cultura de astrócitos ou microglia isoladamente, a produção de tau não aumentou. Os resultados, portanto, forneceram novas evidências de que a comunicação molecular entre microglia e astrócitos é de fato necessária para a patologia da tau fosforilada.
No futuro, a equipe de pesquisa planeja adicionar novos recursos ao miBrains para modelar mais de perto as características de cérebros em funcionamento, como o uso de microfluídica para adicionar fluxo através de vasos sanguíneos ou métodos de sequenciamento de RNA de célula única para aprimorar o perfilamento de neurônios.
Os pesquisadores esperam que o miBrains possa impulsionar descobertas científicas e modalidades de tratamento para a doença de Alzheimer e outras condições.
“Dada a sua sofisticação e modularidade, as possibilidades futuras são ilimitadas”, afirma Stanton. “Entre elas, gostaríamos de aproveitá-la para obter novos conhecimentos sobre alvos terapêuticos, análises avançadas da eficácia terapêutica e otimização de veículos de administração de medicamentos.”
“O que mais me entusiasma é a possibilidade de criar miBrains individualizados para diferentes pessoas”, acrescenta Tsai. “Isso promete abrir caminho para o desenvolvimento da medicina personalizada.”
O financiamento para o estudo veio da BT Charitable Foundation, Freedom Together Foundation, da família Robert A. e Renee E. Belfer, de Lester A. Gimpelson, de Eduardo Eurnekian, de Kathleen e Miguel Octavio, de David B. Emmes, da família Halis, do Picower Institute e de um doador anônimo.