Mundo
Cientistas produzem proteína receptora COVID em células de camundongos
Uma equipe de cientistas do Laboratório Nacional Brookhaven do Departamento de Energia dos EUA (DOE) e da Universidade de Columbia demonstrou uma maneira de produzir grandes quantidades do receptor ao qual o SARS-CoV-2...
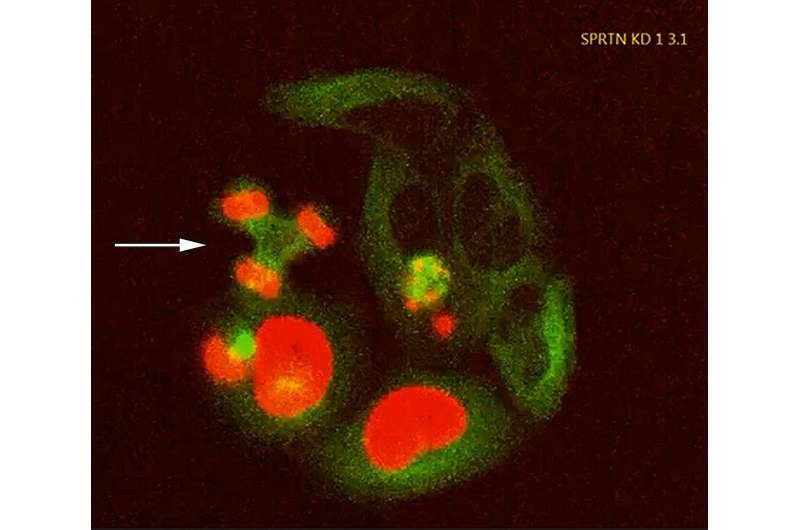
Os cientistas usaram microscopia de fluorescência para visualizar proteínas ACE2 humanas expressas em células de camundongos após incubar as células com a proteína spike SARS-CoV-2 marcada com fluorescência (verde). Esquerda: uma visão do meio das células com a seta apontando para a membrana celular. À direita: uma visão da superfície da membrana de fora das células. A fluorescência azul corresponde ao DNA nos núcleos das células. Angela Kim, do grupo de apoio aos usuários do Laboratório de Radiação Espacial da NASA, forneceu assistência especializada com a microscopia. Crédito: Laboratório Nacional de Brookhaven
Uma equipe de cientistas do Laboratório Nacional Brookhaven do Departamento de Energia dos EUA (DOE) e da Universidade de Columbia demonstrou uma maneira de produzir grandes quantidades do receptor ao qual o SARS-CoV-2, o vírus que causa o COVID-19, se liga na superfície. de células humanas. Essa ligação entre a agora infame proteína viral e o receptor humano “ACE2” é o primeiro passo da infecção pelo vírus. A produção da proteína ACE2 humana funcional em células de camundongos dá aos cientistas uma nova maneira de estudar esses receptores e potencialmente colocá-los em uso. Além disso, conforme descrito em artigo publicado recentemente na revista Virology, o método poderia facilitar o estudo de outras proteínas complexas que se revelaram difíceis de produzir por outros meios.
O objetivo inicial dos cientistas de Brookhaven, no início da pandemia, era produzir grandes quantidades de ACE2 humana e depois anexar a proteína a nanopartículas. As nanopartículas revestidas com ACE2 poderiam então ser testadas como terapêutica antiviral e/ou como sensores para detecção de partículas virais.
"Para qualquer uma dessas aplicações, são necessárias grandes quantidades de proteína, e a proteína tem que ser totalmente funcional", disse Paul Freimuth, virologista do Brookhaven Lab, que liderou a pesquisa em colaboração com cientistas do Centro de Nanomateriais Funcionais (CFN) do Brookhaven Lab. "Mas produzir proteínas de membrana funcionais como ACE2 é particularmente desafiador porque o processo pelo qual as proteínas são localizadas na membrana celular é complexo."
Uma razão é que essas proteínas são modificadas de várias maneiras após serem sintetizadas e antes de serem inseridas na membrana celular. Em particular, as moléculas de hidratos de carbono adicionadas às proteínas desempenham papéis fundamentais tanto na forma como a longa cadeia proteica se dobra na sua estrutura 3D final como na forma como a proteína funciona na membrana.
“Os carboidratos representam cerca de um terço da massa da proteína ACE2”, disse Freimuth.
As células mais simples que os cientistas usam para gerar proteínas artificialmente, nomeadamente bactérias, não possuem as enzimas para anexar esses complementos de hidratos de carbono. Assim, a equipe de Brookhaven recorreu a células de camundongos, que, como mamíferos, são mais parecidos conosco – e, portanto, são capazes de fazer o mesmo tipo de processamento de carboidratos. Sabe-se que as células de camundongos são hábeis em captar e expressar genes “estranhos”. E embora as células do rato também produzam um receptor ACE2, a versão da proteína no rato não se liga ao pico do SARS-CoV-2. Isso significa que os cientistas teriam uma maneira fácil de ver se as células do rato produziam a proteína ACE2 humana – verificando se os picos se ligariam às células.
Encontrar e expressar o gene ACE2
Para aumentar as chances de as células de camundongo incorporarem e lerem o gene ACE2 humano corretamente, o grupo utilizou o gene intacto. Os genes dos seres humanos e de outros “organismos superiores” contêm muitas informações além da sequência de DNA que codifica os blocos de aminoácidos que constituem uma proteína. Essa informação extra ajuda a regular a estrutura e a função dos genes nos cromossomos da célula.
Os cientistas pesquisaram bibliotecas de fragmentos de DNA clonados que foram gerados como parte do Projeto Genoma Humano – um esforço patrocinado pelo DOE para mapear a localização de todos os genes que nos tornam humanos – para encontrar um fragmento que continha o gene ACE2 intacto, completo. com suas informações regulatórias incorporadas. Então, eles expuseram células de camundongos a nanopartículas revestidas com esse fragmento de DNA, além do gene de outra proteína que torna as células resistentes a um antibiótico letal.
“Neste caso, as nanopartículas servem como um agente de entrega de DNA que é engolfado pelas células para que o DNA possa potencialmente ser integrado aos cromossomos das células do camundongo”, disse Freimuth. "Para encontrar as células que captaram o(s) gene(s) estranho(s), adicionamos o antibiótico às culturas celulares . As células que não conseguiram captar e expressar o gene de resistência aos antibióticos morreram, enquanto aquelas que adquiriram resistência aos antibióticos sobreviveram e cresceram em colônias ."
Os cientistas expandiram cerca de 50 dessas colónias em culturas individuais e depois testaram-nas para determinar quantas também tinham captado o gene ACE2 humano e produzido a proteína receptora humana.
Detectando a produção de proteínas
“Cerca de 70% das colônias resistentes a antibióticos expressaram a proteína ACE2 humana na superfície celular”, disse Freimuth. “Uma análise mais aprofundada mostrou que estas colónias continham, em média, 28 cópias do gene ACE2 humano”.
É importante ressaltar que as células do camundongo mantiveram as cópias “estranhas” do gene ACE2 e continuaram produzindo a proteína ACE2 humana codificada por esses genes por pelo menos 90 gerações de células.
O nível de proteína ACE2 humana produzida pelas células foi geralmente proporcional ao número de cópias do gene ACE2 integradas no genoma do ratinho. Vários clones de células de camundongo produziram cerca de 50 vezes mais ACE2 do que normalmente está presente nas células de camundongo.
Os cientistas usaram uma variedade de métodos para testar se as proteínas ACE2 humanas produzidas em camundongos eram funcionais. Estas incluíram a demonstração de que um “pseudovírus” contendo a proteína Spike da COVID – isto é, um substituto não patogénico do SARS-CoV-2 – poderia ligar-se aos receptores e infectar as células.
"Esses ensaios de infectividade mostraram que a proteína ACE2 humana expressa nessas células de camundongos é totalmente funcional", disse Freimuth.
Usos e implicações
Enquanto isso, Oleg Gang e Feiyue Teng, coautores do estudo do CFN, exploraram várias maneiras de criar nanovesículas extracelulares enriquecidas com ACE2 humano chamariz para o tratamento potencial de COVID-19. Eles também estão investigando a colocação de proteínas ACE2 em nanopartículas para aplicações potenciais no tratamento de infecções ou na detecção rápida de vírus.
"O desafio colocado pelas nanovesículas baseadas em ACE2 reside em aumentar o seu efeito de neutralização contra o SARS-CoV-2. Também estamos procurando maneiras de melhorar e aproveitar a sensibilidade e especificidade de ligação das nanopartículas acopladas a ACE2 para torná-las úteis para vírus diagnósticos. Ambas as abordagens exigiriam esforços de otimização futuros", disse Teng, pesquisador associado do CFN que trabalhou extensivamente nos aspectos biológicos deste estudo e nas potenciais aplicações baseadas em nanociência.
"Estamos entusiasmados em combinar os avanços na fabricação de nanomateriais com abordagens biomoleculares para o desenvolvimento de novas estratégias terapêuticas e de detecção", disse Gang, que tem um cargo conjunto na Universidade de Columbia. "Este estudo nos permitiu superar alguns problemas metodológicos, uma vez que os nanomateriais e os biossistemas exigiam abordagens de caracterização bastante diferentes. O que aprendemos aqui é importante para nossos próximos passos no aprimoramento do biossensor baseado em nanopartículas."
Além de permitir possíveis aplicações da proteína ACE2 recombinante, o trabalho também demonstra uma nova abordagem para a produção de uma ampla gama de proteínas complexas. Os exemplos incluem a vasta gama de receptores de superfície celular que medeiam inúmeros processos biológicos e de doenças, bem como proteínas industrialmente importantes, como anticorpos monoclonais e enzimas.
"Nosso método de usar genes intactos junto com células de camundongos que podem ser adaptadas para crescer em enormes culturas em suspensão - muito parecidas com as culturas em caldo líquido usadas para cultivar bactérias - poderia promover a produção em larga escala dessas e de outras proteínas importantes", disse Freimuth.
Mais informações: Feiyue Teng et al, Superexpressão da proteína ACE2 humana em fibroblastos de camundongos estavelmente transfectados com o gene ACE2 intacto, Virology (2024). DOI: 10.1016/j.virol.2024.109988
Informações da revista: Virologia