Mundo
Como uma ferramenta de reparo de DNA defeituosa acelera o envelhecimento
Uma forma particularmente grave de dano ao DNA são as chamadas ligações cruzadas DNA-proteína (DPCs), nas quais proteínas se ligam ao DNA. As DPCs podem surgir do consumo de álcool, da exposição a substâncias como...
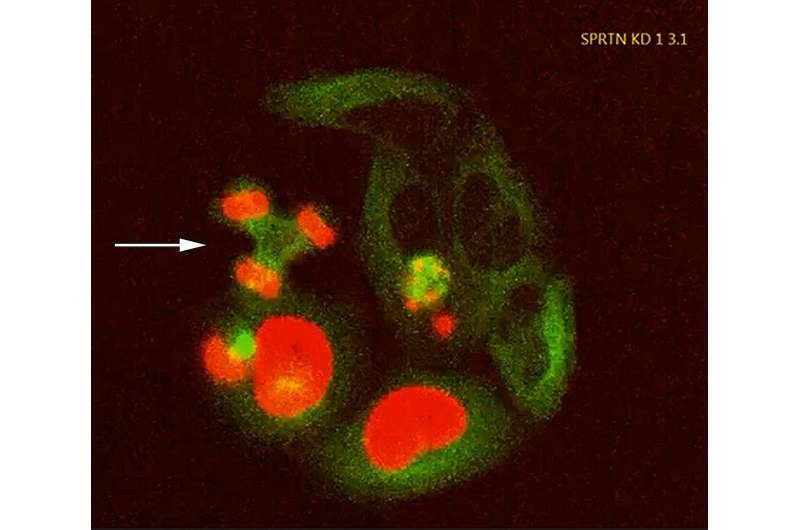
A falha da enzima de reparo SPRTN nessas células cultivadas leva a erros fatais na divisão celular, por exemplo, distribuindo os cromossomos (vermelho) para três núcleos de células-filhas em vez de dois (seta). Verde: Aparelho de divisão celular/citoesqueleto. Crédito: Instituto de Bioquímica II, Universidade Goethe de Frankfurt
Embora o DNA esteja compactado e protegido dentro do núcleo celular, ele está constantemente ameaçado por danos causados ??por processos metabólicos normais ou por estressores externos, como radiação ou substâncias químicas. Para combater isso, as células contam com uma complexa rede de mecanismos de reparo. Quando esses sistemas falham, os danos ao DNA podem se acumular, prejudicar a função celular e contribuir para o câncer, o envelhecimento e doenças degenerativas.
Uma forma particularmente grave de dano ao DNA são as chamadas ligações cruzadas DNA-proteína (DPCs), nas quais proteínas se ligam ao DNA. As DPCs podem surgir do consumo de álcool, da exposição a substâncias como formaldeído ou outros aldeídos, ou de erros cometidos por enzimas envolvidas na replicação e reparo do DNA. Como as DPCs podem causar erros graves durante a divisão celular, interrompendo a replicação do DNA, as ligações cruzadas DNA-proteína representam uma séria ameaça à integridade do genoma.
A enzima SPRTN remove os DPCs clivando as ligações cruzadas entre DNA e proteína. O mau funcionamento da SPRTN, por exemplo, como resultado de mutações, pode predispor os indivíduos ao desenvolvimento de deformidades ósseas e câncer de fígado na adolescência. Essa rara doença genética é conhecida como síndrome de Ruijs-Aalfs. Seu mecanismo subjacente permanece pouco compreendido e não existem terapias específicas.
A proteína SPRTN protege o DNA como um capacete, reparando as ligações cruzadas entre DNA e proteínas (ilustração artística). Crédito: Anne-Claire Jacomin, Universidade Goethe de Frankfurt.
Vazamento de DNA dispara alarmes imunológicos
Uma equipe de pesquisa liderada pelo Prof. Ivan Ðiki?, do Instituto de Bioquímica II da Universidade Goethe, demonstrou que a perda da função da enzima SPRTN não leva apenas ao acúmulo de DNA danificado no núcleo da célula. Utilizando experimentos com culturas de células e camundongos geneticamente modificados, eles descobriram que, além disso, o DNA do núcleo também vaza para o interior da célula, o citoplasma. A pesquisa foi publicada na revista Science .
O DNA no citoplasma é reconhecido pela célula como um sinal de perigo, visto que esse DNA geralmente se origina de vírus ou bactérias invasoras ou de transformação maligna. O DNA citoplasmático , portanto, ativa mecanismos de defesa na célula, iniciando a chamada via de sinalização cGAS-STING. Além disso, a célula libera substâncias mensageiras que atraem células imunes, levando à inflamação crônica.
Inflamação crônica e efeitos do envelhecimento
A equipe de pesquisa liderada por Frankfurt observou que essa resposta inflamatória crônica é especialmente pronunciada nos embriões de camundongos e persiste na idade adulta, particularmente nos pulmões e no fígado. Como resultado, os camundongos morreram precocemente ou apresentaram sinais de envelhecimento precoce semelhantes aos observados em pessoas com síndrome de Ruijs-Aalfs. O bloqueio da resposta imune relevante aliviou muitos dos sintomas.
"As ligações cruzadas não reparadas entre DNA e proteínas têm consequências sistêmicas mais amplas", explica Ðiki?. "Elas não apenas comprometem a estabilidade do genoma, mas também causam inflamação crônica, que pode influenciar significativamente a expectativa de vida."
Abrindo portas para terapias direcionadas
O médico e biólogo molecular vê potencial para o desenvolvimento de terapias: "Além da síndrome de Ruijs-Aalfs, existem outras doenças genéticas raras nas quais as ligações cruzadas entre DNA e proteínas desempenham um papel importante. Com nosso trabalho, lançamos uma base importante para futuras abordagens terapêuticas também para essas doenças."
"Ao estudar os mecanismos subjacentes dessas doenças raras, descobrimos uma nova ligação entre danos ao DNA, respostas inflamatórias e a expectativa de vida de um organismo. Isso também contribui para a compreensão da biologia do envelhecimento."
Detalhes da publicação
Ines Tomaskovic et al, Ligações cruzadas de DNA-proteína promovem envelhecimento prematuro e letalidade embrionária impulsionados por cGAS-STING, Science (2026). DOI: 10.1126/science.adx9445
Informações sobre o periódico: Ciência