Mundo
Nanopartícula biomimética restaura ação de antibiótico contra superbactéria prioritária da OMS
A resistência antimicrobiana é uma preocupação crescente na medicina moderna. Neste estudo, os autores desenvolvem uma nanoplatataforma que utiliza íons de cério para interromper a produção de energia bacteriana e as bombas de efluxo, restaurando...
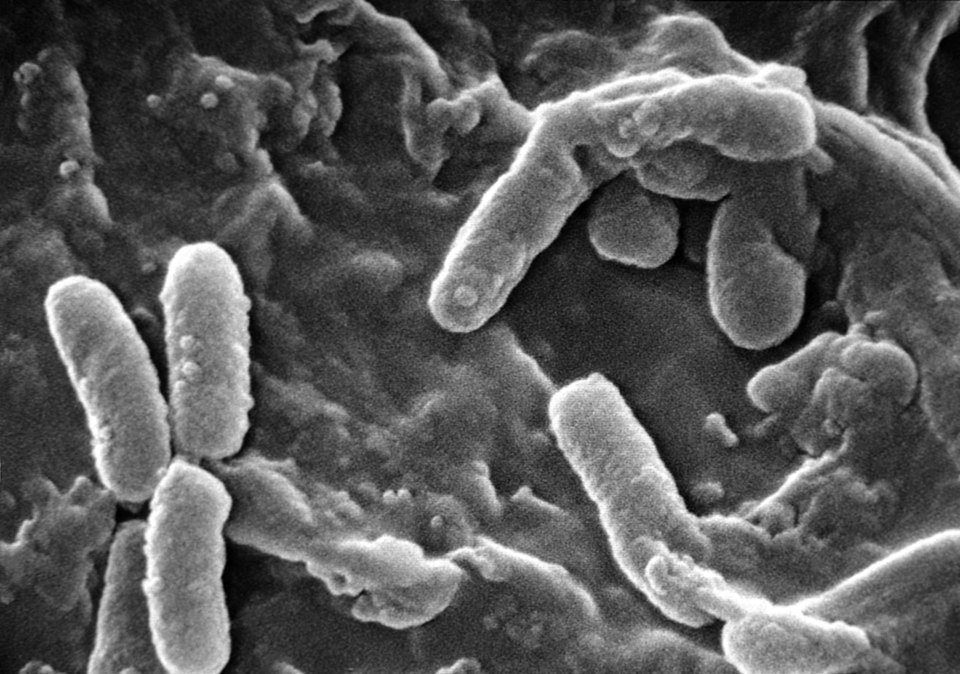
Micrografia eletrônica de varredura de Pseudomonas aeruginosa. ZoomViewer
Uma plataforma nanotecnológica inspirada em vesículas naturais do gengibre conseguiu reverter a resistência de uma das bactérias mais problemáticas da atualidade a um antibiótico clássico. O resultado, publicado neste domingo (15), na revista Nature Communications, reacende a esperança de reaproveitar fármacos antigos contra microrganismos que já não respondiam ao tratamento.
O estudo, liderado por pesquisadores da Beijing University of Chemical Technology, na China, descreve uma nanopartícula híbrida capaz de restaurar a eficácia da carbenicilina contra cepas resistentes de Pseudomonas aeruginosa, patógeno prioritário para a Organização Mundial da Saúde (OMS) por seu alto potencial de resistência e letalidade em ambientes hospitalares.
Resistência crescente e poucas novidades
Infecções por P. aeruginosa estão associadas a pneumonias hospitalares, infecções em pacientes imunossuprimidos — como os com fibrose cística —, septicemia e meningite bacteriana. O relatório CHINET de 2022 já apontava a bactéria entre os principais agentes de infecção respiratória na prática clínica.
O problema é histórico: desde a década de 1980, pouco se avançou no desenvolvimento de novos antibióticos eficazes contra bactérias Gram-negativas. Paralelamente, o uso excessivo e inadequado de antimicrobianos acelerou a emergência de cepas resistentes.
No experimento chinês, quando a bactéria foi exposta repetidamente à carbenicilina isolada, a concentração mínima inibitória (MIC) aumentou 256 vezes após 30 gerações — um retrato clássico da evolução da resistência. Já com a nova formulação nanoparticulada, o surgimento de resistência foi significativamente retardado.
Estratégia: esgotar a energia da bactéria
A inovação combina três elementos:
Carbenicilina, antibiótico -lactâmico tradicional;
Íons de cério (Ce??), metal com atividade redox capaz de interferir no metabolismo bacteriano;
Vesículas extracelulares derivadas de gengibre, que funcionam como “capa biomimética”, aumentando o tempo de circulação no organismo e favorecendo o acúmulo em tecidos inflamados.
Segundo os autores, o diferencial não está apenas no transporte direcionado, mas no mecanismo bioenergético. Os íons de cério liberados no ambiente ácido da infecção penetram na bactéria e reduzem drasticamente os níveis de ATP — a principal “moeda energética” celular.
Nos testes, a formulação foi capaz de reduzir em 60% o ATP intracelular em concentrações mais altas, comprometendo a fosforilação oxidativa; o funcionamento da cadeia respiratória; a atividade das bombas de efluxo — mecanismos que expulsam antibióticos do interior da célula.
“Ao bloquear o suprimento energético, impedimos que a bactéria utilize suas bombas de efluxo para eliminar o antibiótico”, afirmam os autores no artigo. “Isso restaura a sensibilidade à carbenicilina mesmo em cepas previamente resistentes.”
Sinergia comprovada em laboratório
O índice de concentração inibitória fracionada (FICI) foi de 0,5, valor que indica efeito sinérgico entre cério e antibiótico. Em condições ácidas (pH 5,5), que simulam o microambiente inflamatório, a sobrevivência bacteriana caiu para 3,19%, enquanto em pH fisiológico permaneceu acima de 80%, mostrando liberação seletiva do fármaco no local da infecção.
Em cultura de cepas resistentes, a diferença foi ainda mais expressiva: enquanto a carbenicilina isolada permitia mais de 70% de sobrevivência bacteriana em determinadas concentrações, a formulação nanoparticulada reduziu a viabilidade para 0,19%.
O efeito também foi observado contra Klebsiella pneumoniae, outra Gram-negativa associada a pneumonias hospitalares.
Teste em modelo animal
No modelo murino de pneumonia por P. aeruginosa resistente, todos os animais tratados com solução salina, carbenicilina isolada ou nanopartículas sem revestimento morreram em até 36 horas.
Já o grupo tratado com a nanopartícula biomimética apresentou sobrevida significativamente maior, com redução de duas ordens de magnitude na carga bacteriana pulmonar após 12 horas. A formulação também evitou a disseminação sistêmica da infecção para órgãos como fígado, baço e rins.
A meia-vida circulante da nanopartícula foi estimada em 6,68 horas, com eliminação quase completa em até sete dias, sem acúmulo relevante em órgãos ou sinais significativos de toxicidade em análises sanguíneas e histológicas.
Segurança e potencial clínico
Testes in vitro mostraram viabilidade celular superior a 80% mesmo em concentrações elevadas (512 g/mL), e a taxa de hemólise foi inferior a 5%, sugerindo boa compatibilidade biológica.
Os autores argumentam que a estratégia representa uma mudança conceitual: em vez de buscar apenas novas moléculas antibióticas, o foco passa a ser reprogramar o metabolismo bacteriano para reativar drogas já existentes.
“A capacidade de simultaneamente depletar ATP, inibir bombas de efluxo e direcionar o antibiótico ao foco infeccioso oferece um caminho promissor para enfrentar a resistência antimicrobiana”, escrevem.
A resistência antimicrobiana é apontada por organismos internacionais como uma das maiores ameaças à saúde global. Estimativas amplamente divulgadas projetam milhões de mortes anuais até meados do século se o problema não for contido.
Embora ainda em estágio pré-clínico, o estudo sugere que plataformas híbridas — combinando biotecnologia vegetal, nanotecnologia e química de coordenação metálica — podem ampliar a vida útil do arsenal antibiótico disponível.
Em um cenário de escassez de novas moléculas e aumento contínuo da resistência, estratégias de “ressensibilização” podem se tornar peça central na próxima geração de terapias contra superbactérias.
Referência
Ye, Y., Zhang, K., Wang, Y. et al. Nanoplataforma biomimética de coordenação metal-fármaco para neutralizar a resistência a medicamentos em Pseudomonas aeruginosa por meio da interrupção energética. Nat Commun (2026). https://doi.org/10.1038/s41467-026-69712-6