Mundo
Estrutura revela mecanismo ancestral que regula enzima-chave da reciclagem celular
Estudo publicado na eLife identifica segundo sítio de ligação da proteína RAB5 no complexo VPS34-CII e sugere origem evolutiva do mecanismo
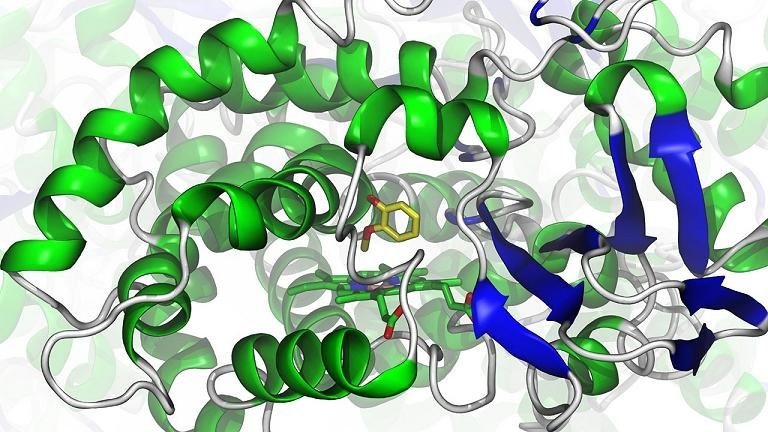
Uma descoberta estrutural pode redefinir o entendimento sobre como as células organizam o tráfego interno de membranas — processo essencial para reciclagem de proteínas, resposta imune e até infecção viral. Pesquisadores do MRC Laboratory of Molecular Biology, em Cambridge, identificaram um segundo sítio de ligação da proteína RAB5 no complexo humano VPS34-CII, uma enzima central na produção de lipídios sinalizadores.
O trabalho, liderado por Saule Špokaite e Roger L. Williams, foi publicado nesta quinta-feira (20), na revista eLife, e combina microscopia crioeletrônica de alta resolução (cryo-EM), mutagênese dirigida, ensaios bioquímicos e experimentos em leveduras para mapear com precisão a interação molecular.
Um complexo essencial para a célula
A enzima VPS34 pertence à classe III das fosfatidilinositol 3-quinases (PI3Ks) — considerada a forma mais ancestral do grupo e presente em todos os eucariotos. Ela catalisa a produção de PI3P, um fosfolipídio que regula o amadurecimento de endossomos, a fagocitose e a autofagia.
No interior celular, VPS34 atua em dois grandes complexos multiproteicos:
VPS34-CI, associado à autofagia
VPS34-CII, ligado ao tráfego endossomal
O novo estudo mostra que o complexo VPS34-CII pode se ligar simultaneamente a duas moléculas da GTPase RAB5A, proteína responsável por recrutar o complexo às membranas dos endossomos iniciais.
“Foi surpreendente observar uma segunda região de ligação no subunidade VPS15. Essa parece ser a região primordial de interação ao longo da evolução”
Roger L. Williams, autor correspondente do estudo.
Estrutura do complexo II e sua atividade em GUVs.
No complexo II em forma de Y, o par Vps30/Vps38 em um braço envolve o par Vps15/Vps34 no outro braço. As extremidades de ambos os braços se ligam às membranas. Somente o complexo II do tipo selvagem forma PI3P em GUVs; em contraste, o complexo I e o mutante de dedo aromático do complexo II são inativos. O PI3P é detectado por uma proteína sensora (vermelha) que se liga às GUVs (verde). Os complexos I e II apresentam atividades semelhantes em pequenas vesículas.
Dois pontos de ancoragem — e mais atividade
Até então, acreditava-se que a ativação de VPS34-CII por RAB5 ocorria em um único ponto, localizado na subunidade VPS34. A nova estrutura, resolvida a 3,2 Å de resolução, revelou um segundo sítio na proteína VPS15.
Segundo os experimentos cerca de 15% das partículas analisadas exibiam duas moléculas de RAB5A ligadas simultaneamente; mutação isolada em um dos sítios reduziu parcialmente a atividade enzimática; e a combinação de mutações nos dois sítios aboliu completamente a ativação por RAB5A.
“Os dados indicam que ambos os sítios são necessários para a ativação plena do complexo”, descrevem os autores.
Ensaios em levedura reforçaram a hipótese evolutiva: enquanto o sítio recém-identificado na VPS15 é altamente conservado, o sítio da VPS34 não aparece preservado em espécies como Saccharomyces cerevisiae. Isso sugere que o mecanismo de dupla ancoragem pode ter surgido como adaptação a sistemas endocíticos mais complexos em organismos superiores.
Especificidade molecular
O estudo também esclarece como diferentes proteínas RAB recrutam complexos distintos. A GTPase RAB1A, por exemplo, ativa preferencialmente o complexo VPS34-CI, enquanto RAB5A ativa o CII.
As diferenças residem na geometria do sítio de ligação e na conformação das regiões “Switch” das GTPases — pequenas mudanças estruturais que determinam qual complexo será recrutado.
“Não se trata apenas da presença da proteína RAB, mas da forma como ela se encaixa no complexo”, apontam os pesquisadores.
Implicações biológicas e médicas
A relevância do achado vai além da biologia estrutural. Vias dependentes de VPS34 e PI3P participam de processos críticos como: degradação de receptores celulares; resposta imunológica e controle de infecções virais.
Estudos recentes indicam que vírus podem sequestrar essas vias para facilitar sua replicação. Entender com precisão como o complexo é ativado pode abrir caminhos para intervenções terapêuticas futuras.
Além disso, o trabalho identificou um motivo estrutural inesperado na subunidade BECLIN1: um dedo de zinco coordenado por dois motivos CXXC, estrutura até então pouco caracterizada.
Um avanço fundamental
A avaliação editorial da própria revista classificou o estudo como “um avanço fundamental na compreensão da localização e regulação do VPS34”.
Ao revelar que o complexo pode interagir com duas moléculas de RAB5 simultaneamente — e que esse mecanismo tem raízes evolutivas profundas — o trabalho amplia o entendimento sobre como as células organizam sua logística interna.
Em um cenário em que disfunções no tráfego endossomal estão associadas a doenças neurodegenerativas, câncer e infecções, desvendar esses detalhes moleculares não é apenas uma curiosidade estrutural, mas um passo estratégico na biologia celular contemporânea.
Referência
Saule Spokaite, Yohei Ohashi, Maxime Bourguet, Antoine N Dessus, Roger L Williams 2026 Um novo sítio de ligação RAB5 em VPS34-CII humano que provavelmente é o sítio primordial na evolução eucariótica eLife 15 : RP110040. https://doi.org/ 10.7554/eLife.110040.1