Saúde
Um novo candidato a medicamento pode reduzir cistos renais
Um composto originalmente desenvolvido para tratar o câncer poderia ser reaproveitado para tratar a doença renal policística, uma doença hereditária que pode levar à insuficiência renal.
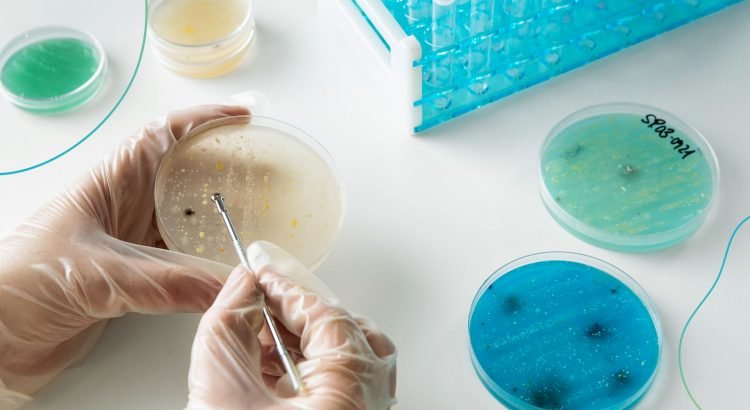
Pesquisadores do MIT, incluindo Robert Croy (à esquerda) e Bogdan Fedeles, descobriram que um medicamento que eles desenvolveram originalmente como um potencial tratamento contra o câncer também pode ser promissor no tratamento da doença renal policística autossômica dominante (ADPKD). Crédito: Melanie Gonick, MIT
A doença renal policística autossômica dominante (DRPAD), a forma mais comum de doença renal policística, pode levar ao aumento do tamanho dos rins e eventual perda de função. A doença afeta mais de 12 milhões de pessoas em todo o mundo, e muitos pacientes acabam precisando de diálise ou transplante de rim quando chegam aos 60 anos.
Pesquisadores do MIT e da Escola de Medicina da Universidade de Yale descobriram agora que um composto originalmente desenvolvido como um potencial tratamento contra o câncer é promissor no tratamento da ADPKD. A droga funciona explorando a vulnerabilidade das células dos cistos renais ao estresse oxidativo – um estado de desequilíbrio entre os radicais livres prejudiciais e os antioxidantes benéficos.
Em um estudo empregando dois modelos da doença em ratos, os pesquisadores descobriram que a droga reduziu drasticamente os cistos renais sem prejudicar as células renais saudáveis.
“Acreditamos realmente que isto tem potencial para impactar o campo e fornecer um paradigma de tratamento diferente para esta importante doença”, diz Bogdan Fedeles, cientista pesquisador e gerente de programa do Centro de Ciências de Saúde Ambiental do MIT e autor principal do estudo, que aparece esta semana nos Anais da Academia Nacional de Ciências.
John Essigmann, professor William R. e Betsy P. Leitch de Engenharia Biológica e Química no MIT; Sorin Fedeles, diretor executivo do Polycystic Kidney Disease Outcomes Consortium e professor assistente (adjunto) da Escola de Medicina da Universidade de Yale; e Stefan Somlo, professor de medicina e genética do CNH Long e chefe de nefrologia da Escola de Medicina da Universidade de Yale, são os autores seniores do artigo.
Células sob estresse
ADPKD normalmente progride lentamente. Frequentemente diagnosticada quando os pacientes estão na faixa dos 30 anos, geralmente não causa comprometimento grave da função renal até os pacientes atingirem os 60 anos. O único medicamento aprovado pela FDA para tratar a doença, o tolvaptano, retarda o crescimento dos cistos, mas tem efeitos colaterais que incluem micção frequente e possíveis danos ao fígado.
O laboratório de Essigmann não se propôs originalmente a estudar a doença renal policística; o novo estudo surgiu do trabalho sobre potenciais novos medicamentos para o câncer. Há quase 25 anos, o cientista pesquisador do MIT Robert Croy, também autor do novo estudo PNAS, projetou compostos que contêm um agente prejudicial ao DNA conhecido como mostarda de anilina, que pode induzir a morte celular em células cancerígenas.
Em meados da década de 2000, Fedeles, então estudante de graduação no laboratório de Essigmann, juntamente com Essigmann e Croy, descobriram que, além de danificar o DNA, esses compostos também induzem estresse oxidativo ao interferir nas mitocôndrias – as organelas que geram energia para as células.
As células tumorais já estão sob estresse oxidativo devido ao seu metabolismo anormal. Quando são tratados com estes compostos, conhecidos como compostos 11beta, a ruptura adicional ajuda a matar as células. Num estudo publicado em 2011, Fedeles relatou que o tratamento com compostos 11beta suprimiu significativamente o crescimento de tumores de próstata implantados em ratos.
Uma conversa com seu irmão, Sorin Fedeles, que estuda a doença renal policística, levou a dupla a teorizar que esses compostos também poderiam ser bons candidatos para o tratamento de cistos renais. Na altura, a investigação sobre ADPKD começava a sugerir que as células dos quistos renais também sofriam stress oxidativo, devido a um metabolismo anormal que se assemelha ao das células cancerígenas.
“Estávamos conversando sobre um mecanismo do que seria um bom medicamento para a doença renal policística e tivemos a intuição de que os compostos com os quais eu estava trabalhando poderiam realmente ter um impacto na ADPKD”, diz Bogdan Fedeles.
Os compostos 11beta funcionam perturbando a capacidade das mitocôndrias de gerar ATP (as moléculas que as células usam para armazenar energia), bem como um cofator conhecido como NADPH, que pode atuar como um antioxidante para ajudar as células a neutralizar os radicais livres prejudiciais. As células tumorais e as células dos cistos renais tendem a produzir níveis aumentados de radicais livres devido ao estresse oxidativo que sofrem. Quando estas células são tratadas com compostos 11beta, o stress oxidativo extra, incluindo a depleção adicional de NADPH, empurra as células para o limite.
“Um pouco de estresse oxidativo é bom, mas as células císticas têm um limiar baixo para tolerá-lo. Enquanto as células normais sobrevivem ao tratamento, as células císticas morrerão porque excedem o limite”, diz Essigmann.
Diminuindo cistos
Usando dois modelos diferentes de ADPKD em camundongos, os pesquisadores mostraram que o 11beta-dicloro pode reduzir significativamente o tamanho dos cistos renais e melhorar a função renal.
Os pesquisadores também sintetizaram uma versão “desfigurada” do composto chamado 11beta-dipropil, que não inclui nenhuma capacidade de danificar diretamente o DNA e pode ser potencialmente mais segura para uso em humanos. Eles testaram este composto no modelo de início precoce da PKD e descobriram que era tão eficaz quanto o 11beta-dicloro.
Em todas as experiências, as células renais saudáveis não pareceram ser afetadas pelo tratamento. Isso porque as células saudáveis são capazes de resistir a um pequeno aumento no estresse oxidativo, ao contrário das células doentes, que são altamente suscetíveis a quaisquer novos distúrbios, dizem os pesquisadores. Além de restaurar a função renal, o tratamento também melhorou outras características clínicas da DRPAD; os biomarcadores para inflamação e fibrose dos tecidos diminuíram nos ratos tratados em comparação com os animais de controle.
Os resultados também sugerem que, nos pacientes, o tratamento com compostos 11beta uma vez a cada poucos meses, ou mesmo uma vez por ano, poderia atrasar significativamente a progressão da doença e, assim, evitar a necessidade de terapias antiproliferativas contínuas e onerosas, como o tolvaptano.
“Com base no que sabemos sobre o paradigma do crescimento do cisto, você poderia, em teoria, tratar os pacientes de maneira pulsátil – uma vez por ano, ou talvez com menos frequência – e ter um impacto significativo no volume renal total e na função renal”, diz Sorin Fedeles.
Os pesquisadores esperam agora realizar mais testes com o 11beta-dipropil, bem como desenvolver formas de produzi-lo em maior escala. Eles também planejam explorar compostos relacionados que poderiam ser bons candidatos a medicamentos para a PKD.
Outros autores do MIT que contribuíram para este trabalho incluem a cientista pesquisadora Nina Gubina, o ex-pós-doutorado Sakunchai Khumsubdee, a ex-pós-doutorado Denise Andrade e os ex-alunos de graduação Sally S. Liu '20 e o estudante cooperativo Jake Campolo. A pesquisa foi financiada pela Fundação PKD, pelo Departamento de Defesa dos EUA, pelos Institutos Nacionais de Saúde e pelo Instituto Nacional de Ciências da Saúde Ambiental através do Centro de Ciências da Saúde Ambiental do MIT.