Saúde
Estudo revela como nossos ossos são reparados por células-tronco
As descobertas podem levar a novas terapias que aceleram a recuperação de lesões, melhoram a saúde óssea e aumentam a longevidade do desempenho.
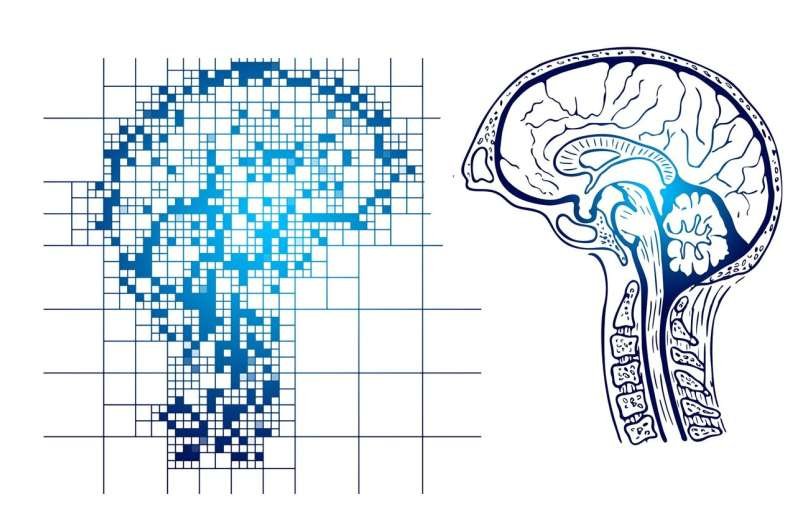
Corte histológico de um osso humano. Cada ponto representa uma única célula. As cores refletem regiões distintas, cada uma com tipos e proporções específicas de células-tronco esqueléticas. | Cortesia de Thomas Ambrosi
Seja você um atleta competitivo ou um adulto mais velho, ossos fortes são essenciais – não apenas para o movimento, mas também para a saúde em geral. Agora, um estudo financiado em parte pela Wu Tsai Human Performance Alliance lançou uma nova luz sobre como nossos ossos são mantidos e reparados por células-tronco – e como esse processo é interrompido com a idade e em situações de cicatrização deficiente. As descobertas podem abrir portas para terapias que aceleram a recuperação de lesões, melhoram a saúde óssea e aumentam a longevidade do desempenho.
“As células-tronco são a fonte de toda a formação óssea nova e, portanto, esse tipo de trabalho é realmente a base para o desenvolvimento de novos tratamentos para condições de saúde esquelética precária e regeneração de fraturas retardada ou prejudicada”, disse Thomas Ambrosi, que liderou este estudo enquanto era pesquisador de pós-doutorado no laboratório de Charles Chan na Universidade Stanford e, posteriormente, em seu cargo atual como professor assistente de Cirurgia Ortopédica na UC Davis. O estudo foi publicado na revista Cell Stem Cell .
“Este trabalho exemplifica a missão da Wu Tsai Human Performance Alliance de promover a ciência que ajuda as pessoas a se manterem saudáveis, se recuperarem mais rapidamente e atingirem o desempenho máximo”, disse Michael Longaker, médico, autor sênior do estudo, professor da Faculdade de Medicina da Universidade Stanford e membro da Wu Tsai Human Performance Alliance em Stanford. “Ao descobrir como as células-tronco esqueléticas mudam com a idade e como restaurar sua função, estamos construindo uma base para terapias regenerativas que podem aprimorar a recuperação e restaurar a mobilidade após lesões.”
Células-tronco são células especializadas que podem gerar novos tecidos continuamente. No passado, cientistas que estudavam a formação e a cicatrização óssea se concentraram no papel das células estromais mesenquimais (MSCs) mal definidas, encontradas na medula óssea e em outras partes do corpo. Mas estudos clínicos que testaram os benefícios das MSCs na saúde óssea foram em grande parte infrutíferos. Ambrosi e seus colegas suspeitaram que um tipo de célula muito mais raro e difícil de estudar, incorporado ao tecido ósseo – chamado de células-tronco esqueléticas – pode desempenhar um papel mais central.
Para explorar essa ideia, Ambrosi e colaboradores de Stanford, UC Davis, UC San Diego, Universidade do Alabama em Birmingham e Chan Zuckerberg Biohub analisaram células-tronco esqueléticas de dez regiões do esqueleto humano em desenvolvimento e as compararam com células de pacientes adultos ao longo da vida, incluindo pessoas com fraturas que não cicatrizaram e pessoas com doenças ósseas.
Eles descobriram quatro subtipos principais de células-tronco esqueléticas, cada uma especializada na construção de osso, cartilagem, estroma de suporte da medula óssea ou tecido fibroso que fornece suporte. Os pesquisadores também criaram o primeiro mapa espacial de onde essas células-tronco residem dentro dos ossos, ajudando a explicar como diferentes partes do esqueleto desempenham funções distintas, mantêm sua estrutura e respondem a danos.
"Ao descobrir como as células-tronco esqueléticas mudam com a idade e como restaurar sua função, estamos construindo uma base para terapias regenerativas que podem melhorar a recuperação e restaurar a mobilidade após uma lesão.”
Michael Longaker"
Professor da Faculdade de Medicina
Na juventude, esses subtipos de células-tronco esqueléticas se equilibram de forma a sustentar ossos fortes e flexíveis. Mas, à medida que as pessoas envelhecem – ou quando a cicatrização se deteriora após uma lesão – o equilíbrio se altera. As células-tronco cada vez mais favorecem um destino de tecido fibroso, produzindo material semelhante a uma cicatriz em vez de osso.
“Essa mudança é parte do motivo pelo qual os ossos se tornam mais frágeis com a idade e não conseguem se curar adequadamente”, explicou Ambrosi.
Para entender essa mudança com o envelhecimento e a origem dos diferentes tipos de células-tronco, a equipe desenvolveu uma nova abordagem computacional para analisar quais genes estavam ativados ou desativados nas diferentes populações de células-tronco esqueléticas. Isso permitiu identificar redes específicas de genes envolvidos no equilíbrio entre a redução e a promoção da formação óssea.
Munidos dessa percepção, os pesquisadores identificaram uma combinação de duas pequenas moléculas que, juntas, impulsionavam células-tronco envelhecidas ou disfuncionais de volta ao estado de formação óssea. Em placas de laboratório e modelos murinos, células-tronco humanas tratadas com o coquetel de moléculas produziram mais osso, promoveram uma melhor cicatrização de fraturas e imitaram o comportamento de células jovens e saudáveis.
“Os compostos funcionaram conforme sugerido pela nossa abordagem computacional”, disse Ambrosi. “Eles levaram a um aumento significativo na formação óssea mediada por células-tronco no local da fratura.”
Ambrosi enfatizou que os novos resultados ainda não estão prontos para aplicação clínica – e que a maioria dos tratamentos com células-tronco atualmente anunciados para a saúde óssea não se baseia em ciência rigorosa. Mas suas descobertas estabelecem uma base mais ampla para estudos futuros sobre como gerar osso ou cartilagem a partir de células-tronco esqueléticas.
“Os ossos não são apenas a estrutura que dá forma e estrutura aos nossos corpos, mas também o que nos permite realizar movimentos, armazenar minerais essenciais e auxiliar na produção de células sanguíneas”, disse ele. “Compreender a biologia básica do esqueleto é importante para compreender a saúde geral.”
_______
Este trabalho foi apoiado pela Wu Tsai Human Performance Alliance da Universidade de Stanford como parte do Regenerative Rehabilitation Moonshot.
Os coautores incluem: Sahar Taheri, Kun Chen, Rahul Sinha, Yuting Wang, Ethan J. Hunt, L. Henry Goodnough, Matthew P. Murphy, Holly M. Steininger, Malachia Y. Hoover, Franco Felix, Kelly C. Weldon, Lauren S. Koepke, Jan Sokol, Daniel Dan Liu, Liming Zhao, Stephanie D. Conley, Wan-Jin Lu, Maurizio Morri, Norma F. Neff, Noelle L. Van Rysselberghe, Erika E. Wheeler, Yongheng Wang, J. Kent Leach, Augustine Saiz, Aijun Wang, George P. Yang, Stuart Goodman, Julius A. Bishop, Michael J. Gardner, Derrick C. Wan, Irving L. Weissman, Michael T. Longaker, Debashis Sahoo, Charles KF Chan.
Financiamento adicional foi fornecido pelos Institutos Nacionais de Saúde (K99/R00 AG049958-01A1, K99/R00 CA151673, R01 GM138385, UG3 TR002968, UG3 TR003355, R01 AI155696, K99/R00 AG066963, U01 AG086165, R56 DE025597, R01 DE026730, R01 DE021683, R21 DE024230, R01 DE027323, HL099776, U24 DE026914, R21 DE019274, U01 HL099999, R01 CA86065, R01 HL058770, R01 DK115600, R01 AR079211), a Fundação Siebel, a Fundação Médica Heritage, a Fundação do Câncer de Próstata, a Federação Americana para Pesquisa do Envelhecimento - Fundação Nacional de Pesquisa da Artrite (AFAR-ANRF), o Chan Zuckerberg Biohub, o Centro de Saúde da Mulher e Diferenças Sexuais em Medicina da WHSDM Stanford, a Família DiGenova, a Fundação Alemã de Pesquisa (399915929), a Associação de Trauma Ortopédico (4311), o CIRM (TR1-01249, EDUC4-12792), a Fundação Oak, o Laboratório Hagey, o Fundo Pitch Johnson e o Fundo de Pesquisa Gunn/Olivier.
Esta história foi publicada originalmente pela Wu Tsai Human Performance Alliance.