Tecnologia Científica
Novos modelos de tecido podem ajudar pesquisadores a desenvolver medicamentos para doenças hepáticas
Dois modelos reproduzem com maior precisão a fisiologia do fígado, oferecendo uma nova maneira de testar tratamentos para o acúmulo de gordura.
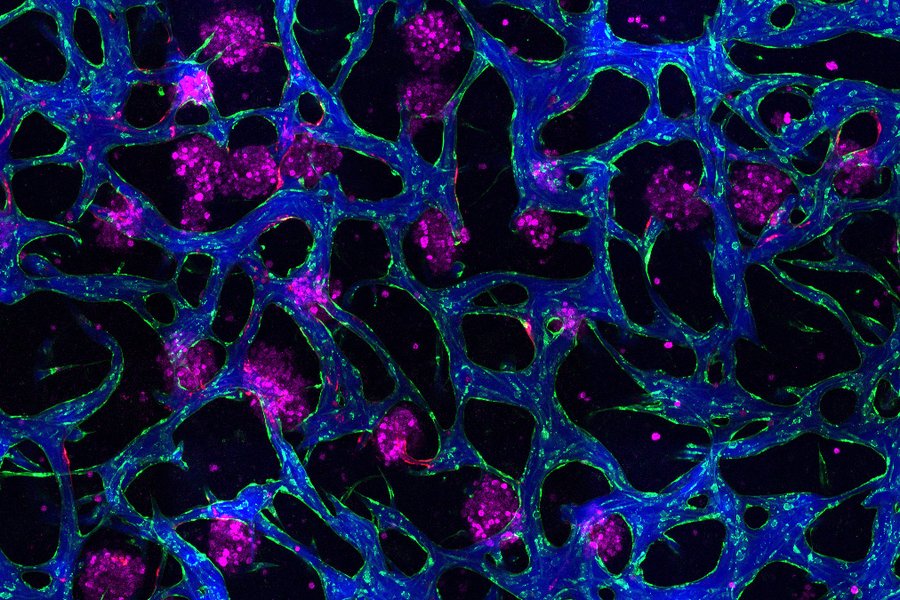
Pesquisadores criaram um mini “fígado em um chip”. Pequenos aglomerados de células hepáticas (mostrados em magenta) estão inseridos em uma rede de vasos sanguíneos (verde). Os vasos podem transportar fluido, mostrado aqui com corante azul, permitindo que os cientistas estudem como a doença hepática se desenvolve. Créditos: Imagem: Erin Tevonian e Ellen Kan
Mais de 100 milhões de pessoas nos Estados Unidos sofrem de doença hepática esteatótica associada à disfunção metabólica (DHEM), caracterizada pelo acúmulo de gordura no fígado. Essa condição pode levar ao desenvolvimento de doenças hepáticas mais graves, que causam inflamação e fibrose.
Na esperança de descobrir novos tratamentos para essas doenças hepáticas, engenheiros do MIT desenvolveram um novo tipo de modelo de tecido que imita com mais precisão a arquitetura do fígado, incluindo vasos sanguíneos e células imunológicas.
Ao relatarem suas descobertas nesta semana na revista Nature Communications, os pesquisadores mostraram que esse modelo pode replicar com precisão a inflamação e a disfunção metabólica que ocorrem nos estágios iniciais da doença hepática. Tal dispositivo poderia ajudar os pesquisadores a identificar e testar novos medicamentos para tratar essas condições.
Este é o estudo mais recente de um esforço maior desta equipe para usar esses tipos de modelos de tecido, também conhecidos como sistemas microfisiológicos, para explorar a biologia do fígado humano, que não pode ser facilmente replicada em camundongos ou outros animais.
Em outro artigo recente, os pesquisadores utilizaram uma versão anterior de seu modelo de tecido hepático para explorar como o fígado responde ao resmetirom. Esse medicamento é usado para tratar uma forma avançada de doença hepática chamada esteato-hepatite associada à disfunção metabólica (MASH), mas é eficaz em apenas cerca de 30% dos pacientes. A equipe descobriu que o medicamento pode induzir uma resposta inflamatória no tecido hepático, o que pode ajudar a explicar por que ele não é eficaz em todos os pacientes.
“Já existem modelos de tecido que conseguem fazer boas previsões pré-clínicas da toxicidade hepática de certos medicamentos, mas precisamos mesmo de modelar melhor os estados da doença, porque agora queremos identificar alvos terapêuticos, queremos validar esses alvos. Queremos analisar se um determinado medicamento pode ser mais útil no início ou no final do curso da doença”, afirma Linda Griffith, professora de Inovação no Ensino da Escola de Engenharia do MIT, professora de engenharia biológica e engenharia mecânica, e autora principal de ambos os estudos.
O ex-pós-doutorando do MIT, Dominick Hellen, é o autor principal do artigo sobre o resmetirom, publicado em 14 de janeiro na revista Communications Biology . Erin Tevonian, doutoranda de 2025, e a candidata ao doutorado Ellen Kan, ambas do Departamento de Engenharia Biológica, são as autoras principais do artigo publicado hoje na Nature Communications sobre o novo sistema microfisiológico.
Modelagem da resposta a medicamentos
No artigo publicado na revista Communications Biology, o laboratório de Griffith trabalhou com um dispositivo microfluídico que ela desenvolveu originalmente na década de 1990, conhecido como LiverChip. Este chip oferece uma estrutura simples para o cultivo de modelos 3D de tecido hepático a partir de hepatócitos, o principal tipo de célula do fígado.
Este chip é amplamente utilizado por empresas farmacêuticas para testar se seus novos medicamentos têm efeitos adversos no fígado, o que é uma etapa importante no desenvolvimento de medicamentos, pois a maioria dos fármacos é metabolizada pelo fígado.
Para o novo estudo, Griffith e seus alunos modificaram o chip para que ele pudesse ser usado para estudar a MASLD (Distúrbio de Aprendizagem de Masson-Golgi).
Pacientes com MASLD, um acúmulo de gordura no fígado, podem eventualmente desenvolver MASH, uma doença mais grave que ocorre quando se forma tecido cicatricial, chamado fibrose, no fígado. Atualmente, o resmetirom e o medicamento GLP-1 semaglutida são os únicos medicamentos aprovados pelo FDA para tratar MASH. Encontrar novos medicamentos é uma prioridade, afirma Griffith.
“Nunca se declara vitória no tratamento da doença hepática com um único medicamento ou classe de medicamentos, porque a longo prazo pode haver pacientes que não podem usá-los, ou eles podem não ser eficazes para todos os pacientes”, afirma ela.
Para criar um modelo de MASLD, os pesquisadores expuseram o tecido a altos níveis de insulina, juntamente com grandes quantidades de glicose e ácidos graxos. Isso levou ao acúmulo de tecido adiposo e ao desenvolvimento de resistência à insulina, uma característica frequentemente observada em pacientes com MASLD e que pode levar ao diabetes tipo 2.
Uma vez estabelecido esse modelo, os pesquisadores trataram o tecido com resmetirom, um medicamento que age imitando os efeitos do hormônio da tireoide, que estimula a quebra de gordura.
Para sua surpresa, os pesquisadores descobriram que esse tratamento também poderia levar a um aumento na sinalização imunológica e nos marcadores de inflamação.
“Como o resmetirom tem como principal objetivo reduzir a fibrose hepática na MASH, consideramos o resultado bastante paradoxal”, afirma Hellen. “Suspeitamos que essa descoberta possa ajudar clínicos e cientistas a entender por que apenas uma parcela dos pacientes responde positivamente ao medicamento tiromimético. No entanto, são necessários experimentos adicionais para elucidar melhor o mecanismo subjacente.”
Um modelo de fígado mais realista
No artigo publicado na Nature Communications , os pesquisadores descreveram um novo tipo de chip que permite reproduzir com maior precisão a arquitetura do fígado humano. O principal avanço foi o desenvolvimento de uma maneira de induzir o crescimento de vasos sanguíneos no tecido. Esses vasos podem fornecer nutrientes e também permitir que as células imunológicas circulem pelo tecido.
“Criar modelos mais sofisticados de fígado que incorporem características de vascularização e tráfego de células imunes, que possam ser mantidos por um longo período em cultura, é muito valioso”, diz Griffith. “O verdadeiro avanço aqui foi demonstrar que podíamos obter uma rede microvascular complexa através do tecido hepático e que podíamos fazer circular células imunes. Isso nos ajudou a estabelecer diferenças entre como as células imunes interagem com as células do fígado em um estado de diabetes tipo 2 e em um estado saudável.”
À medida que o tecido hepático amadurecia, os pesquisadores induziram resistência à insulina expondo o tecido a níveis elevados de insulina, glicose e ácidos graxos.
À medida que essa condição patológica se desenvolvia, os pesquisadores observaram alterações na forma como os hepatócitos eliminam a insulina e metabolizam a glicose, bem como vasos sanguíneos mais estreitos e permeáveis, que refletem complicações microvasculares frequentemente observadas em pacientes diabéticos. Eles também descobriram que a resistência à insulina leva a um aumento nos marcadores de inflamação que atraem monócitos para o tecido. Os monócitos são precursores dos macrófagos, células imunológicas que auxiliam na reparação tecidual durante a inflamação e também são observadas no fígado de pacientes com doença hepática em estágio inicial.
“Isso realmente demonstra que podemos modelar as características imunológicas de uma doença como a MASLD, de uma forma que seja totalmente baseada em células humanas”, diz Griffith.
A pesquisa foi financiada pelos Institutos Nacionais de Saúde (NIH), pelo programa de Bolsas de Pesquisa para Pós-Graduados da Fundação Nacional de Ciência (NSF), pela NovoNordisk, pelo Centro de Ciências da Vida de Massachusetts e pela Fundação Siebel Scholars.